

|
Druck
|
Der Druck ist definiert als Kraft pro Fläche:
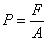
Die SI - Einheit des Druckes ist das Pascal (Pa):
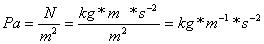
Eine weitere übliche Einheit, die jedoch nicht zum SI - System zählt,ist das Bar, wobei
1 bar = 105 Pa ist.
Zu den veralteten heute nicht mehr zugelassenen Druckeinheiten, die aber noch in älteren
Lehrbüchern zu finden sind, gehören das Torr und die Standard - Atmosphäre, wobei
gilt:
1 atm = 101,325 Pa und 1 torr = 0.1333223 Pa
Zusammenfassend kann man folgende Beziehungen aufstellen:
| Einheit | Beziehung |
| Pa | 1 kg*m-1*s-2 |
| bar | 1*105 Pa |
| atm | 101,325 Pa |
| torr | 1/760 atm |
| 760 mm Hg (0�C) | 1 atm |
| 1 atm | 1,01325 bar |
Die Atmosphäre, in der wir leben, übt ebenfalls einen Druck auf uns aus, auch wenn wir
es nicht immer direkt wahrnehmen.
Diese Tatsache zeigte uns Evangelista Torricelli (1608 - 1647), Galileos Assistent. Er bestimmte
den Atmosphärendruck mit Hilfe eines Barometers.
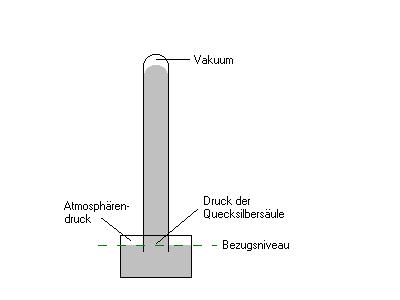
Er nahm ein Rohr, das an einem Ende geschlossen
und ungefähr 85 cm lang war. Das andere Ende tauchte er in eine mit flüssigem Quecksilber gefüllte
Schale. Das Quecksilber im Rohr sank auf ein bestimmtes Mass weit ab. Der Atmosphärendruck,
der aussen auf die Quecksilberoberfläche drückt, hält eine Säule bestimmter Höhe
im Rohr fest. Bei Torricellis Experiment was dies eine ungefähr 760 mm hohe Säule. Der Zwischenraum
zwischen dem Quecksilber und dem Rohrende ist ein fast perfektes Vakuum. Da Quecksilber bei
Raumtemperatur nur sehr wenig flüchtig ist, befindet sich nur eine vernachlässigbare
Menge Quecksilberdampf im Zwischenraum. Der Druck innerhalb der Röhre auf der Höhe des
Bezugsniveaus stammt alleine vom Gewicht der Quecksilbersäule; dieser Druck ist gleich dem
aussen herrschenden Atmosphärendruck.
Die Höhe der Quecksilbersäule ist ein direktes Mass für den Atmosphärendruck.
Dieser ist abhängig von der Höhenlage des Standortes und in geringem Masse vom Wetter.
Der mittlere Druck auf Höhe des Meeresspiegels bei 0°C hält eine Quecksilbersäule
auf 760 mm Höhe. Dieser Druck wird Normaldruck genannt.
Normaldruck:
| | |
| 1 atm | = 101,325 kPa |
| | = 1013,25 mbar |
| | = 760 Torr |
| | = 760 mm Hg (0�C) |
Bei Torricellis Experiment stoppte die Quecksilbersäule bei ungefähr 760 mm Höhe.
Mit diesem Wert und dem Newtonschen Gesetz F = m*a können wir selbst den Normaldruck berechnen:
Die Quecksilberatome befinden sich im Gravitationsfeld der Erde und werden somit mit der Kraft
F = m*g mit g = 9.80665 m*s-2 angezogen.
Wir kennen bereits, dass der Druck als Kraft pro Fläche definiert ist. Somit folgt :
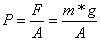
Das Volumen von Quecksilber im Barometer ist gegeben durch V = A*h, wobei h die Höhe der Säule
ist.
Daraus folgt, dass der Druck auch definiert werden kann als
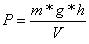
Nun können wir diesen Ausdruck noch in Abhängigkeit von der Dichte bringen:
mit 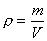 folgt
folgt 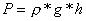
Indem wir für die Dichte 1.35951*10-4 kg m-3 und für die Höhe 0.76 m einsetzen,
erhalten wir für den Normaldruck einen Wert von 1.01325*105 Pa.
Der Druck in einem Behälter lässt sich mit einem Manometer messen.
Ursprüngliche Manometer bestehen aus einem U - Rohr, das Quecksilber enthält. Das eine
Ende ist mit einem Behälter verbunden; das Gas übt Druck auf das Quecksilber aus.
Der andere Schenkel ist verschlossen und luftleer. Der Höhenunterschied der Quecksilberspiegel
in beiden Schenkeln, in mm gemessen, ist ein direktes Mass für den Druck im Behälter.
Falls das obere Ende offen ist, dann zeigt die Höhendifferenz der Quecksilberspiegel die Differenz
des Druckes im Behälter gegenüber dem Atmosphärendruck an.
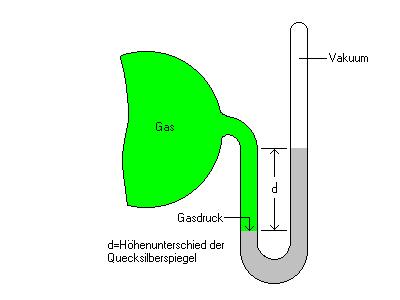
Ein Manometer

![]()
![]()

