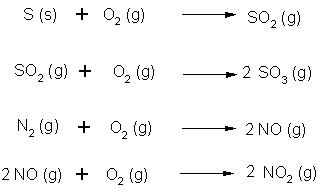|
Einführung
|
Gase bestehen aus räumlich weit voneinader getrennten Molekülen oder Atome in schneller
Bewegung. Mehrere Gase können in jedem Verhältnis völlig homogen vermischt werden.
Grund dafür ist der relativ grosse Raum zwischen zwei Gasteilchen. Diese Tatsache verleiht
den Gasen auch die Eigenschaft der Kompressibilität und der Expansion.
Ein sehr bekanntes Gas ist Luft. Sie besteht zum grössten Teil aus Stickstoff und Sauerstoff:
| Gas | Formel | prozentualer Anteil |
| Stickstoff | N2 | 78.110 |
| Sauerstoff | O2 | 20.953 |
| Argon | Ar |
0.934 |
| Kohlenstoffdioxid | CO2 | 0.034 |
| Neon | Ne | 1.82*10-3 |
| Helium | He | 5.2*10-4 |
| Methan | CH4 | 1.5*10-4 |
| Krypton | Kr | 1.1*10-4 |
| Wasserstoff | H2 | 5*10-5 |
| Distickstoffoxid | N2O | 3*10-5 |
| Xenon | Xe | 8.7*10-8 |
Daneben gibt es noch weitere Bestandteile, die jedoch mit variablem Anteil auftreten:
| Gas | Formel | prozentualer Anteil |
| Wasser | H2O | 0 - 7 |
| Ozon |
O3 | 0 - 7*10-6 |
| Kohlenstoffmonoxid | CO | 0 - 2*10-6 |
| Stickstoffdioxid | NO2 | 0 - 2*10-6 |
| Schwefeldioxid | SO2 | 0 * 1*10-4 |
Gase nehmen ein gegebenes Volumen vollständig ein. Sie entstehen durch physikalische Prozesse
(Verdampfung, Sublimation) oder durch durch chemische Reaktionen.
Einige typische gasbildende chemische Reaktionen sind:
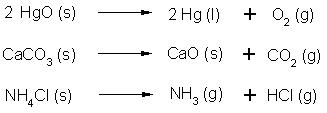
Erhitzen einiger Feststoffe:
Einige gasbildende Reaktionen verlaufen sogar explosionsartig:
Zersetzung von Nitroglycerin:
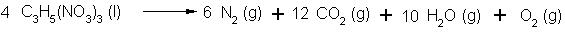
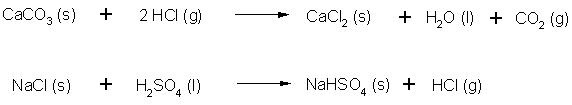
Reaktion von Säuren mit einigen ionischen Feststoffen:
Reaktion mit Sauerstoff unter Bildung von Oxiden:
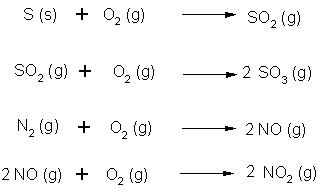
In den nächsten Kapiteln werden wir uns mit einigen Begriffen wie Druck und Temperatur auseinandersetzen,
einige grundlegende Gasgesetze kennenlernen und uns einen Einblick in die mikroskopische Welt der Gase (kinetische Gastheorie)
gewähren.